

洛科ROCKER儀器讓過濾更簡單!
北京卓信宏業(yè)儀器設(shè)備有限公司
聯(lián)系人:高經(jīng)理
電 話:010-82938685
郵 箱:sale@bjzx17.com
胞外囊泡 (Extracellular Vesicles, EVs) 因其具有作為生物標(biāo)志 (biomarker) 和*工具 (therapeutic tools) 的巨大潛力而在生物學(xué)和醫(yī)學(xué)領(lǐng)域日益受到關(guān)注。 然而,EVs 的異質(zhì)性 (heterogeneity) 和復(fù)雜性也為新手帶來許多挑戰(zhàn)。
深入技術(shù)細(xì)節(jié)及詳情,請(qǐng)見專文:
? 從探索到驗(yàn)證:為何需要“外泌體標(biāo)準(zhǔn)品”?
? 如何使用切向流過濾純化外泌體?
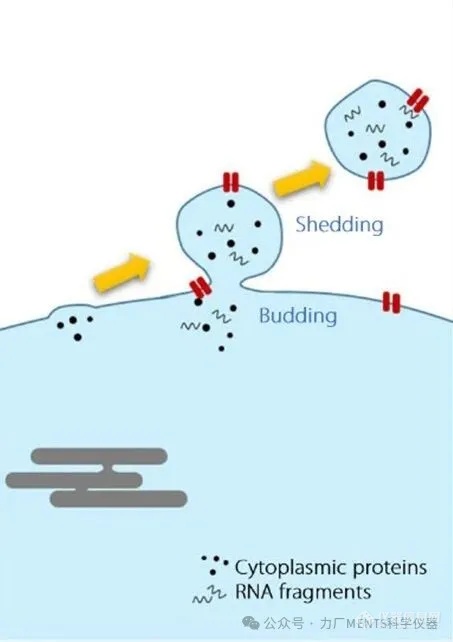
胞外囊泡 (Extracellular Vesicles, EVs) 是指從細(xì)胞釋放、由脂雙層膜包裹 (delimited by a lipid bilayer) 且無自我復(fù)制能力 (replicate) 的顆粒。 在早期研究中,將 EVs 依其生物起源 (biogenesis) 和尺寸 (size) 主要分為3大類:
|
外泌體 (Exosomes) |
微囊泡 (Microvesicles) |
凋亡小體 (Apoptotic bodies) | |
|
|  |
| |
|
尺寸 |
40 ~ 120 nm |
100 ~ 1000 nm |
1000 ~ 5000 nm |
|
生物起源 |
多囊體(MVB),透過內(nèi)吞途徑 |
細(xì)胞膜,透過向外出芽 |
細(xì)胞膜,細(xì)胞凋亡過程 |
|
標(biāo)志& 組成 |
Tetraspanin (CD9, CD63, CD81), Alix, Tsg101, flotillin-1 |
Selectins, Integrins |
DNA, histones, cell organelles, Nuclear fractions, Annexin V. |
然而,國際胞外囊泡學(xué)會(huì)(ISEV)在MISEV2018及MISEV2023建議:若無明確的生物起源證據(jù),優(yōu)先采用作性命名,可依囊泡的物理特征、表面標(biāo)志、細(xì)胞狀況或形態(tài)進(jìn)行命名,如 sEV (小EVs)、lEV (大EVs) 及 CD63+ EV 等通用術(shù)語。
外泌體 (exosomes) 指源于胞內(nèi)體系統(tǒng) (endosomal system) 且經(jīng)多囊體 (MVB) 釋放的 EVs; 惟在實(shí)務(wù)上難以直接證明起源,故在缺乏證據(jù)時(shí)不建議泛用此術(shù)語。 其常見報(bào)導(dǎo)尺寸約介于 40 ~ 120 nm間,常見標(biāo)志為四跨膜蛋白 (tetraspanins),如 CD9、CD63、CD81 等。 外泌體可攜帶其親代細(xì)胞 (parent cell) 的核酸 (DNA、RNA)、脂質(zhì)和蛋白質(zhì)等分子訊息,并傳遞至受體細(xì)胞 (recipient cell) 調(diào)控其功能,影響多種生理功能及疾病進(jìn)程,具強(qiáng)大的*潛力,故成為近年研究熱點(diǎn)。
EVs 研究涉及多個(gè)關(guān)鍵步驟,包含樣品準(zhǔn)備到*后的分析和儲(chǔ)存各步驟都會(huì)影響EVs的品質(zhì)。
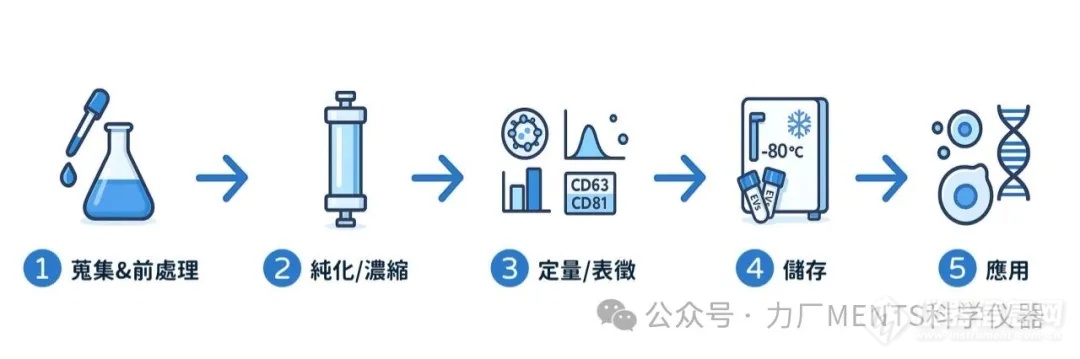
目的:獲取含有 EVs 的原始生物材料,并盡早移除細(xì)胞及特定污染物。
材料:EVs 可從生物源獲取,如細(xì)胞培養(yǎng)液 (cell culture-conditioned medium)、細(xì)菌 (bacteria)、血液 (blood)、尿液 (urine) 、牛奶 (milk) 等。
通用建議:
請(qǐng)報(bào)告樣品來源、數(shù)量(如體積、重量)及采集的方法及儲(chǔ)存的所有細(xì)節(jié)。
? 從原始材料中盡早移除細(xì)胞,否則細(xì)胞破損可能形成類天然 EVs 的顆粒; 細(xì)胞死亡及活化也可能會(huì)改變 EVs 的組成和功能。
? 建議在樣本儲(chǔ)存之前先完成必要的前處理,以去除可能的干擾物質(zhì),如細(xì)胞。
? 樣品儲(chǔ)存可能對(duì) EVs 產(chǎn)生影響,請(qǐng)避免反復(fù)凍融循環(huán) (freeze‐thaw cycles)。
? 報(bào)告 EVs 分離前后的所有儲(chǔ)存條件,含防腐劑 (preservatives) 或冷凍劑 (cryoprotectants)、溫度、時(shí)間、冷凍程序、儲(chǔ)存容器、凍融循環(huán)次數(shù)和解凍方法。
* 本文僅列通用建議,針對(duì)各類樣品之個(gè)別建議,請(qǐng)查閱 MISEV2023
目的:從原始生物材料中分離 EVs、提高 EVs 濃度,同時(shí)盡可能減少非 EVs 成分 (如游離蛋白、脂蛋白、細(xì)胞碎片等) 的干擾。
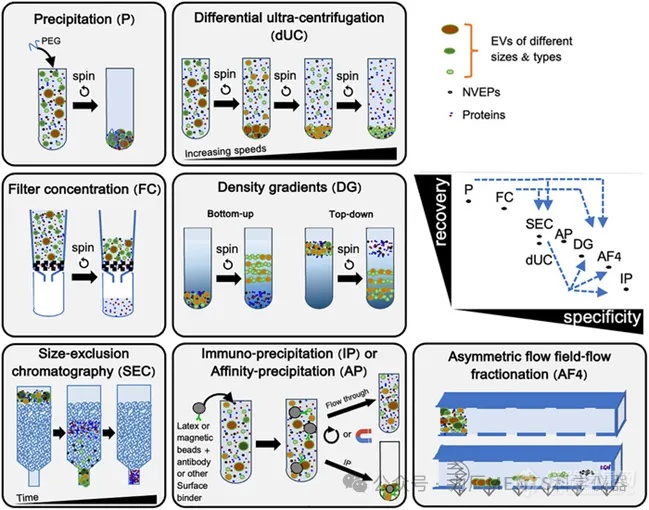
純化方法:每種方法的回收率 (recovery) 及特異性 (specificity) 皆有所不同,應(yīng)依據(jù)樣品的特性選擇不同的分離 (isolation) 或富集 (enrichment)方法,如差速離心法 (dUC)、密度梯度離心法 (DG, dgUC)、 超過濾法 (UF)、粒徑篩析層析法 (SEC)、沈淀法 ( precipitation) 等。
通用建議:
依據(jù) EVs 的來源特性、研究目的以及所需的 EVs 產(chǎn)率和特異性來決定分離方法。
? 需要更高純度的 EVs 時(shí),可考慮串聯(lián)兩種以上不同原理的純化方法
? 大體積材料來源可能需要先濃縮再分離會(huì)更有效率,如 CCM、尿液、牛奶。
? 針對(duì)市售商業(yè)套組,應(yīng)優(yōu)先選擇公開分離原理及成分細(xì)節(jié)的套組。
? 所有 EV 分離方法皆建議提供純度與回收率佐證。
? 提供足夠的方法細(xì)節(jié)以利重現(xiàn)每個(gè)分離和濃縮步驟。
? 評(píng)估或建議新分離/濃縮方法時(shí),請(qǐng)?jiān)诿總€(gè)步驟前/后對(duì) EVs 進(jìn)行測試,以估算其富集倍數(shù) (fold enrichment) 及產(chǎn)量 (yield)。
延伸閱讀:如何使用切向流過濾純化外泌體?
目的:確認(rèn)分離的顆粒是否為 EVs,可對(duì)其大小、濃度、形態(tài)和生物標(biāo)志物進(jìn)行分析,是驗(yàn)證分離可靠性的關(guān)鍵步驟。
定量及表征方法:EVs 表征方法包含顆粒濃度、蛋白質(zhì)含量、脂質(zhì)含量、總 RNA 含量、EVs 形態(tài)、蛋白質(zhì)組成等。
通用建議:
? EVs 表征應(yīng)至少包含三個(gè)層面的信息:
(1) 特理與定量特性 (如顆粒濃度、粒徑分布),用以描述樣品的整體性質(zhì);
(2) EVs 標(biāo)志物 (如跨膜蛋白、GPI 錨定蛋白、胞質(zhì)或細(xì)胞膜來源蛋白),以確認(rèn)樣品為 EVs;
(3) 非 EV 共分離成份 (non-EV proteins),用以評(píng)估樣品純度并區(qū)分非 EV 來源的污染物。
? 沒有單一的測量方法能夠滿足所有表征要求,建議使用檢測極限不同的正交法 (orthogonal methods) 進(jìn)行測量。
? 報(bào)告所有分析方法的細(xì)節(jié),包括儀器、參數(shù)和數(shù)據(jù)分析過程,以確保實(shí)驗(yàn)的可重復(fù)性和透明度。
? 建議以生物源定義 EVs 的產(chǎn)量,如細(xì)胞的數(shù)量、生物體液體積、組織重量等。
? 應(yīng)進(jìn)行 EVs 的定量計(jì)算,如顆粒數(shù)量、蛋白質(zhì) (protein) 和/或脂質(zhì) (lipid) 含量。
? 應(yīng)對(duì) EVs 的通用成份或特定成份進(jìn)行測試,尤其有特異性要求時(shí),如 EVs 亞型 (EV subtypes)。
? 應(yīng)根據(jù)希望達(dá)到的特異性對(duì)EV制劑進(jìn)行測試,以確定是否存在與EV亞型或EV相關(guān)的成分。
? 需確定非囊泡 (non-vesicular)、共分離 (co-isolated) 成分的存在程度。
? 使用定量指標(biāo)來表征 EVs 時(shí),提供儀器及方法檢測極限 (LOD)。
?鼓勵(lì)使用標(biāo)準(zhǔn)品、陰性對(duì)照與多重檢測平臺(tái)交叉驗(yàn)證
延伸閱讀:從探索到驗(yàn)證:為何需要“外泌體標(biāo)準(zhǔn)品”?
目的:維持已分離 EVs 的完整性、功能和穩(wěn)定性,以供后續(xù)實(shí)驗(yàn)使用。 不當(dāng)?shù)膬?chǔ)存會(huì)影響 EVs 的特性 (characteristics),包括穩(wěn)定性 (stability)、顆粒數(shù)量、聚集 (aggregation) 和功能 (function)。
通用建議:
報(bào)告 EVs 分離前后的所有儲(chǔ)存條件,含防腐劑 (preservatives) 或冷凍劑 (cryoprotectants)、溫度、時(shí)間、冷凍程序、儲(chǔ)存容器、凍融循環(huán)次數(shù)和解凍方法。
? 避免反復(fù)凍融循環(huán) (freeze-thaw cycles),建議可分裝 (aliquoting) 使用。
? 建議快速冷凍及解凍樣品,以利*限度地保留 EVs 的形態(tài)和功能。
EVs 的復(fù)雜性常常讓新手陷入一些常見的陷阱
命名混淆
樣品污染:細(xì)胞培養(yǎng)的血清或補(bǔ)充劑常含有大量外源性 EVs 及其它因子。 進(jìn)行 EVs 相關(guān)實(shí)驗(yàn)時(shí),務(wù)必去除內(nèi)含 EVs 或直接使用無血清培養(yǎng)液,減少 EV 污染的可能性。
細(xì)胞干擾:搜集樣品后未能及時(shí)且徹底地移除細(xì)胞,死細(xì)胞或受損細(xì)胞則可能形成類天然 EVs 的顆粒、釋出胞內(nèi)成份、改變 EVs 組成及功能,造成結(jié)果失真。
分離方法選擇不當(dāng):不同的分離方法有不同的回收率和純度及其優(yōu)缺點(diǎn)。 應(yīng)根據(jù)樣品類型、實(shí)驗(yàn)?zāi)康募昂罄m(xù)應(yīng)用,選擇能夠提供足夠純度和回收率的純化方法。
表征不足:未充份表征或未檢測常見污染物 (如脂蛋白lipoprotein),不足以確認(rèn)檢測物為 EVs 或?qū)е聦?shí)驗(yàn)結(jié)論不可靠。 建議采用多種方法進(jìn)行全面的表征。
儲(chǔ)存不當(dāng):反復(fù)凍融、溫度或儲(chǔ)存容器都可能導(dǎo)致 EVs 的完整性、濃度和功能受損。 務(wù)必嚴(yán)格遵循標(biāo)準(zhǔn)儲(chǔ)存流程并詳實(shí)記錄。